04 Velocidad de reaccion entre cinc y sulfurico
En esta experiencia se va vamo a comprobar cómo se puede alterar la velocidad de reacción al cambiar la concentración y al variar la temperatura.
Para ello, se hará reaccionar cinc con cloruro de hidrógeno, recogiéndose el hidrógeno producido en una bureta de gases y cronometrando la
producción de gas para poder comparar las diferentes condiciones.
Enlace al guión de laboratorio.




Material
- Disolución 5M de acido sulfúrico |
.
- El cinc en polvo se suele aglomerar y eso reduce su superficie.
Es conveniente triturarlo en el mortero para disponer de un polvo fino en la reacción. |
Comentarios a la preparación del montaje
- La reacción con sulfúrico a temperatura ambiente es lenta, consumir 0,8 g de Zn con sulfúrico 5M a temperatura ambiente lleva más de una hora.
- Al introducir el sulfúrico en el matraz se desplaza un volumen de aire igual al volumen de disolución introducido,
luego de nada sirve que no quede ninguna burbuja en la probeta.
- Introducir en el matraz 50 cm³ de disolución 3M es mucho más que suficiente.
- Es importante medir el volumen inicial en la probeta inmediatamente después de introducir la disolución de sulfúrico,
para restarlo del volumen total en cada momento y obtener el volumen de hidrógeno producido.
- Si se quisiera afinar los cálculos del gas producido, hay que tener en cuenta la presión de vapor del agua y, más importante,
la presión y temperatura en la probeta cuando se hacen las mediciones.
Pero estas correcciones son prescindibles si tenemos en cuenta la precisión del volumen medido en la probeta.
Aspectos didácticos
Este trabajo pretende:
- Preparar un sistema cerrado de reacción con recogida de gases.
- Hacer una reacción "disolución de ácido - metal en polvo" con desprendimiento de hidrógeno y reactivos en defecto y en exceso.
- Comparar experimentalmente el efecto sobre la velocidad de reacción de la concentración.
- Aplicar la teoría de colisiones para explicar el efecto sobre la velocidad de reacción de la concentración.
- La expresión "ácido sulfúrico" tienen un aura de peligro extremo.
Hay que hacer ver a los alumnos que el ácido que vamos a utilizar está diluido y representa un peligro muy
controlado si no se hacen tonterías como arrojárselo.
- Es didácticamente interesante que los alumnos puedan ver cómo se prepara la disolución 5M en forma de
exhibición magistral, detallando las precauciones que se han de tomar.
- Al prepararla, conviene que toquen el matraz para que comprueben el calor de dilución del sulfúrico con agua,
explicándoles el peligro de dejar caer agua sobre ácido sulfúrico.
- El hidrógeno que se produce es visualmente indistinguible de cualquier otro gas.
Para comprobar que es un gas combustible, al final de la toma de datos, se puede sacar el tubo de la probeta,
encender el gas que sale por el tubo y apagar la luz. Así podrán ver la llama que produce el hidrógeno al quemarse.
 Montaje experimental |
 Montaje experimental |
 Recogida de gases |
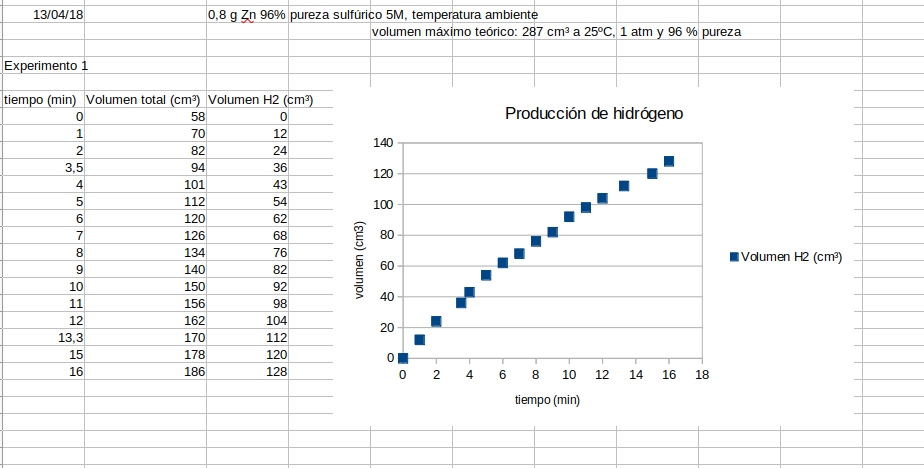 Resultados en experimento de 15 min |
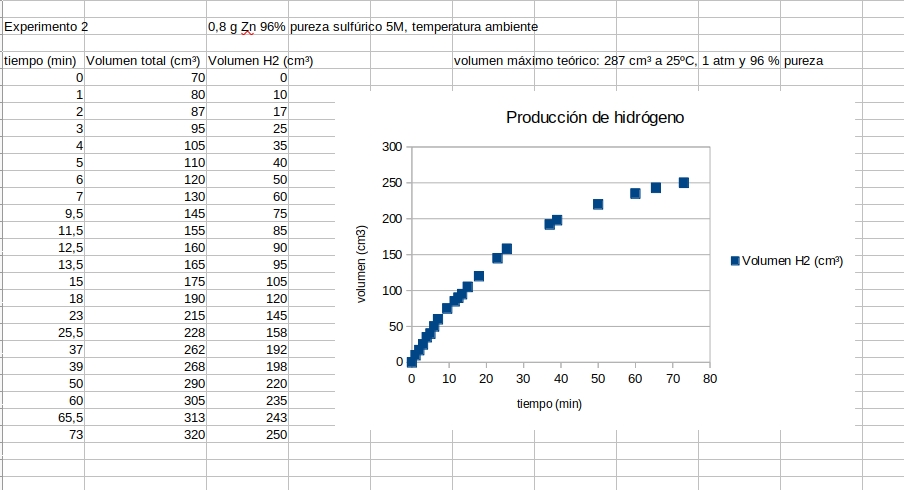 Resultados en experimento en 70 min |

